N.P: Martinez_Piña_E_A_. LCCPW. Logística. A-2. A-F3.21/05/2020.doc.
Links: : http://www.deciencias.net/simulaciones/quimica/reacciones/concentra.htm, http://agrega.educacion.es/repositorio/13032014/64/es_2013121113_9163343/velocidad_de_las_reacciones_qumicas.html, https://brainly.lat/tarea/2642170
“LCCPW”

Links: : http://www.deciencias.net/simulaciones/quimica/reacciones/concentra.htm, http://agrega.educacion.es/repositorio/13032014/64/es_2013121113_9163343/velocidad_de_las_reacciones_qumicas.html, https://brainly.lat/tarea/2642170
“LCCPW”
Velocidad de reacción y concentración
La rapidez con la que se produce una transformación química
es un aspecto muy importante. Tanto desde el punto de vista del conocimiento
del proceso como de su utilidad industrial, interesa conocer la velocidad de la
reacción y los factores que pueden codificarla.
Se define la velocidad [p1] de una reacción química como la
cantidad de sustancia formada (si tomamos como referencia un producto) o
transformada (si tomamos como referencia un reactivo) por unidad de tiempo.
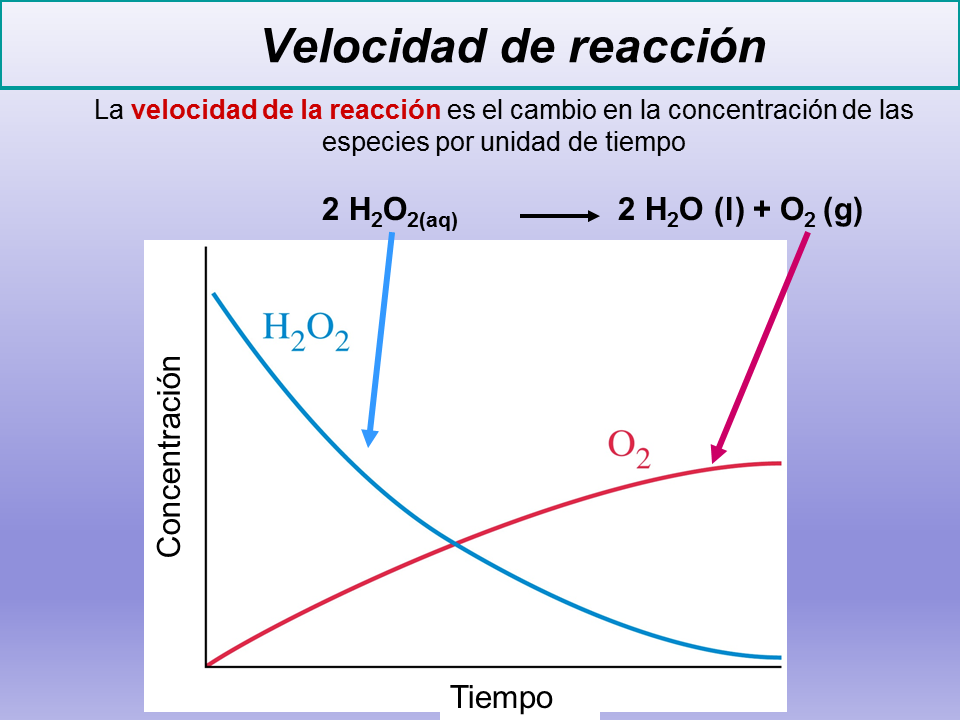
La velocidad de reacción [p2] no es constante. Al principio, cuando la
concentración de reactivos es mayor, también es mayor la probabilidad de que se
den choques entre las moléculas de reactivo, y la velocidad es mayor. a
medida que la reacción avanza, al ir disminuyendo la concentración de los
reactivos, disminuye la probabilidad de choques y con ella la velocidad de la
reacción. La medida de la velocidad de reacción implica la medida de la
concentración de uno de los reactivos o productos a lo largo del tiempo, esto
es, para medir la velocidad de una reacción necesitamos medir, bien la cantidad
de reactivo que desaparece por unidad de tiempo, bien la cantidad de producto
que aparece por unidad de tiempo. La velocidad de reacción se mide en unidades
de concentración/tiempo, esto es, en moles/s.

Son cinco los factores que influyen en la velocidad de una
reacción química.
El aumento de la
concentración de los reactivos hace más probable el choque entre dos moléculas
de los reactivos, con lo que aumenta la probabilidad de que entre estos
reactivos se dé la reacción. En el caso de reacciones en estado gaseoso la concentración de los
reactivos se logra aumentando la presión, con lo que disminuye el volumen.
Si la reacción se lleva a cabo en disolución lo que se hace
es variar la relación entre el soluto y el disolvente.
En la simulación que tienes a la derecha puedes variar la
concentración de una o de ambas especies reaccionantes y observar cómo influye
este hecho en la velocidad de la reacción química.
La velocidad[p3] de una reacción es la cantidad de sustancia
formada o transformada por unidad de tiempo.
Algunas reacciones químicas se producen de forma rápida y
otras son lentas. Por ejemplo, las explosiones y detonaciones son tan rápidas
que resulta muy difícil medir su velocidad, el cemento necesita varios días
para fraguar, es decir, para endurecer, es una reacción lenta.
La velocidad de una reacción depende de:
La energía de activación de la reacción: si la energía de
activación es alta la reacción será lenta y si es baja la reacción será rápida.
El número de choques
eficaces entre las partículas que reaccionan (átomos, moléculas o iones):
cuanto mayor sea el número de choques eficaces mayor será la velocidad de
reacción.
Los factores que afectan a la velocidad de reacción son:
La naturaleza de los reactivos: determina cuál será la
energía de activación de cada reacción.
La concentración de los reactivos: la velocidad de una
reacción aumenta con la concentración de los reactivos ya que aumenta el número
de choques.
Para aumentar la concentración de un gas es necesario
aumentar su presión. Para aumentar la concentración de una disolución habrá que
aumentar la cantidad de soluto.
El estado físico de los reactivos: las reacciones entre gases
y entre sustancias en disolución serán las más rápidas, pues las partículas se
muevan con mayor libertad y velocidad, produciéndose un mayor número de
colisiones entre ellas. Las
reacciones de los sólidos con líquidos o gases no son generalmente muy rápidas,
pero si el sólido está triturado o pulverizado, aumenta la velocidad de
reacción, porque al aumentar la superficie de contacto entre del sólido con el
líquido o el gas, también aumenta el número de choques.
La temperatura: en general la velocidad de reacción aumenta
con la temperatura. Al aumentar temperatura, aumenta la energía cinética de las
partículas (aumenta la velocidad con que se mueven), con lo que la probabilidad
de que se produzcan choques eficaces es mayor.
Los catalizadores[p5] : son sustancias distintas de los reactivos
y productos que modifican la velocidad de una reacción, recuperándose
íntegramente cuando la reacción finaliza.
Los catalizadores hacen que la reacción transcurra por un
camino diferente en que la energía de activación sea otra.
La cinética [p7] química es un área de la
fisicoquímica que se encarga del estudio de la rapidez de reacción, cómo cambia
la rapidez de reacción bajo condiciones variables y qué eventos moleculares se
efectúan mediante la reacción general (difusión, ciencia de superficies,
catálisis). La cinética química es un estudio puramente empírico y
experimental; el área química que permite indagar en las mecánicas de reacción
se conoce como dinámica química.
Experimentalmente la velocidad de una reacción puede ser
descrita a partir de la(s) concentración(es), las especies involucradas en la
reacción y una constante, sin embargo, esta puede depender de numerosos
factores (el solvente utilizado, el uso de catalizadores, fenómenos de
transporte, material del reactor, etc.), haciendo muy complejo el proceso de
determinación de velocidades de reacción.
Se puede clasificar a las reacciones en simples o complejas
dependiendo del número de pasos o de estados de transición que deben producirse
para describir la reacción química: si solo un paso es necesario (un estado de transición) se dice que la
velocidad de reacción es simple y el orden de la reacción corresponde a la suma
de coeficientes estequiométricos de la ecuación, de lo contrario se debe
proponer una serie de pasos (cada uno con un estado de transición) denominado
mecanismo de la reacción que corresponda a la velocidad de reacción encontrada.
Las reacciones también se pueden clasificar cinética mente en
homogéneas y heterogéneas: la primera ocurre en una fase y la segunda en más de
una fase. La reacción heterogénea depende del área de una superficie ya sea la
de las paredes del vaso o de un catalizador sólido. En este capítulo se
discuten reacciones homogéneas.
Reacciones químicas rápidas: Estas reacciones son tan rápidas que ocurren tan
pronto como los reactivos se unen. Generalmente, estas reacciones involucran especies iónicas y, por lo
tanto, se conocen como reacciones iónicas. Estas reacciones tardan entre
10-14 y 10-16 segundos en completarse. Es casi imposible determinar las tasas
de estas reacciones. Algunos de esos ejemplos son:
Precipitación de AgCl
cuando se mezclan soluciones de nitrato de plata y cloruro de sodio.
AgNO3 + NaCl → AgCl + NaNO3
Precipitación de BaSO4 cuando se mezclan soluciones de
cloruro de bario y ácido sulfúrico.
BaCl2 + H2SO4 → BaSO4 + 2HCl
Naturalización de un ácido con una base cuando sus soluciones
acuosas se mezclan.
HCl + NaOH → NaCl + H2O
Sal de base ácida
Combustión de gas metano, la explosión de un hidrocarburo,
muy rápido
CH4 + 2 O2 -> CO2 + 2 H2O + Calor
Combustión de glucosa, cuando nuestro cuerpo metabolismo el
azúcar para obtener energía
C6H12O6 (s) + 6O2 (g) => 6CO2 (g) + 6H2O (l)
Reacciones químicas lentas: Hay
ciertas reacciones que son extremadamente lentas. Deben pasar hasta meses
juntos para mostrar cualquier cambio mensurable a temperatura ambiente.
También es difícil estudiar la cinética de tales reacciones. Algunos ejemplos:
Reacción entre el hidrógeno y el oxígeno a temperatura
ambiente a temperatura ambiente
2 H2 + O2 ----> 2H2O (reacción muy lenta)
Reacción de H2S atmosférico en carbonato de plomo básico.
Pintura blanca básica de carbonato de plomo ---->
Decoloración ennegrecida de la pintura
ocurre muy lentamente (debido a la formación de PbS).
2 PbCO3 · Pb
(OH) 2 + 3 H2S → 3 PbS + 3 H2O + 2 CO2
carbonato básico de plomo + sulfuro de hidrógeno → sulfuro de
plomo + agua + dióxido de carbono
Reacción entre carbono y oxígeno a temperatura ambiente
C + O2 ----> CO2
Reacción entre el monóxido de carbono y el hidrógeno a
temperatura ambiente
CO + 2H2 ----> CH3OH
Comentarios
[p1]la
velocidad de una reacción puede ser descrita a partir de la(s)
concentración(es), las especies involucradas en la reacción y una constante,
sin embargo, esta puede depender de numerosos factores (el solvente utilizado,
el uso de catalizadores, fenómenos de transporte, material del reactor, etc.),
haciendo muy complejo el proceso de determinación de velocidades de reacción.
[p3]La
medida de la velocidad de reacción implica la medida de la concentración de uno
de los reactivos o productos a lo largo del tiempo, esto es, para medir la
velocidad de una reacción necesitamos medir, bien la cantidad de reactivo que
desaparece por unidad de tiempo, bien la cantidad de producto que aparece por
unidad de tiempo.
[p4]La
concentración de los reactivos, El estado físico de los reactivos, La
temperatura, Los catalizadores.
[p5]Pueden
disminuir la energía de activación, entonces la velocidad de la reacción
aumenta, se llaman catalizadores positivos; o pueden aumentar la energía de
activación, entonces la velocidad de la reacción disminuye, se llaman
catalizadores negativos.
[p6]El
objetivo de la cinética química es medir la rapidez de las reacciones químicas
y encontrar ecuaciones que relacionen la celeridad de una reacción.
[p7]medir
la rapidez de las reacciones químicas y encontrar ecuaciones que relacionen la
celeridad de una reacción.



Comentarios
Publicar un comentario